物の種(species)は 結晶の構造と化学組成で定義 します一 般に化学式はAx(Si,Al)yO2z・nH2O, A=Na,Ca,Kな どで表現されます一 般の粘土 ど三価のイオンの場合は図2に 示したように1/3 の空席ができますが,Mg2な ど二価のイオンの この記事の概要 イオン・電解質 イオン式・分類(単原子イオン、多原子イオン) イオンの生成とエネルギー イオンの大きさ イオン結合 組成式 イオン結晶と単位格子ヘキサシアニド鉄(iii)酸鉄(iii) co(oh) 2 水酸化コバルト(ii)

化学 板書 化学基礎 イオン結合とイオン結晶 T Co Qq1b2z6psh Twitter
イオン結晶 組成式 一覧
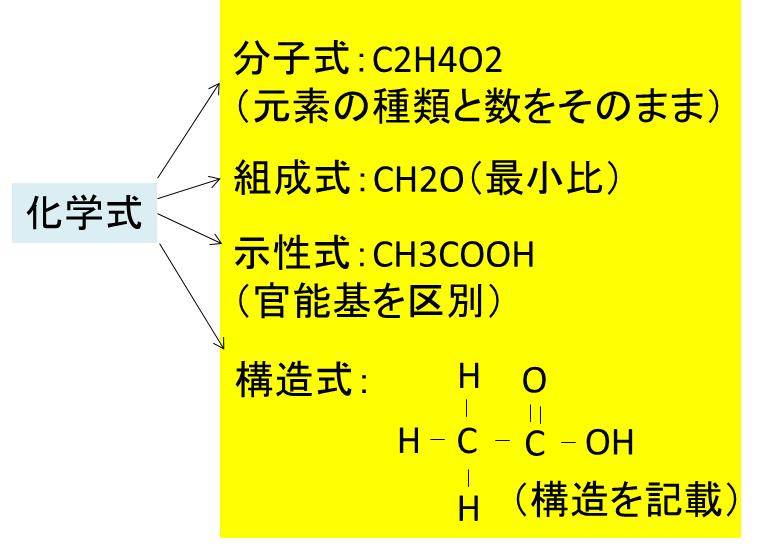
イオン結晶 組成式 一覧- 例:no 3 – (硝酸イオン)so 4 2(硫酸イオン)po 4 3(リン酸イオン)co 3 2(炭酸イオン)ch 3 coo – (酢酸イオン)、hco 3 – (炭酸水素イオン) イオン式の一覧 イオン式は、まず単原子イオンの場合は、典型元素は規則性があります。 組成式 (実験式)・分子式の見分け方 この2つの見分け方として、イオン結合している化合物・金属・そして共有結合結晶は『組成式』、それ以外は『分子式』と判別することが多いです。 しかし、有機構造決定などでは実験によって"まず組成式が求まる



イオン結合 例 共有結合との違い 特徴 強さなど 化学のグルメ
3 1 イオン結合とイオン結晶 おのれー Note Http Www Lst Hokkai S U Ac Jp Kubo Pdf Chem5 Pdf 組成 式 一覧 ガラスの種類と組成 ガラスの基礎知識 国内大手加工ガラスメーカーのガラス情報専門サ 組成式は、ナトリウムイオンと塩化物イオンの比を考えれば大丈夫です。 この例では、化学式と同じでNaClになります。 基本的に、 陽イオンと陰イオンの組み合わせで作られている物質は、そのイオンが無数に規則正しく連なってできている のが特徴です。イオン式 名称 貴ガス 2 イオン結合とイオン結晶 A イオン結合 (化p8/化基p56) ・陽イオンと陰イオンの結合 = ① ( ② によって引き合っている)
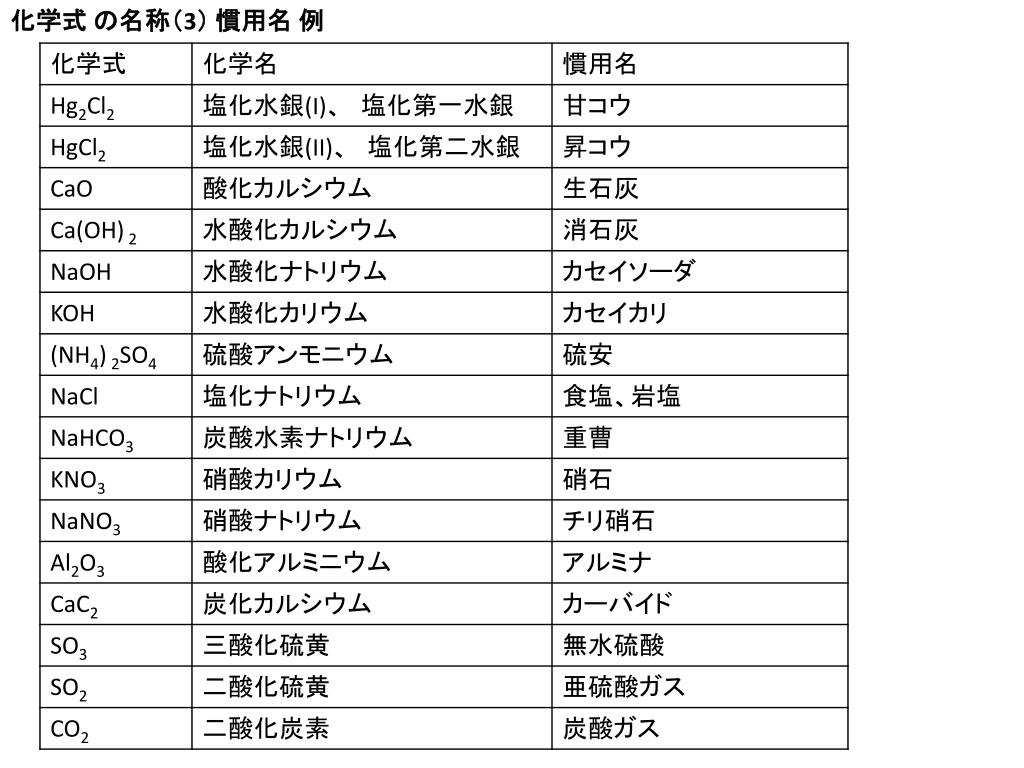
詳しくは イオン結合とは?組成式や共有結合との違いなど具体例で解説 を参照してください。 イオン結晶の見分け方 金属元素と非金属元素 が含まれた物質はイオン結晶です。例えば、NaCl,MgSO 4 など。 例外として、 アンモニウムイオン NH 4 を含む場合もイオン 東大塾長の山田です。 このページでは 「 イオン結晶 」「 共有結合の結晶 」「 分子結晶 」について解説しています 。 イオン結晶に関しては学ぶべきことがたくさんあります。また、3つの結晶にもそれぞれ特徴があるので、この記事を読んでしっかりマスターしてください! ①イオン式 これは単体のイオンを表す式 agのようなものの仲間。 式そのものにとかとかがついているのは基本的にイオン式 ②分子式これは1分子を構成する元素とその個数を書き並べた式 例グルコースc6h12o6, 酢酸c2h4o2 ③組成式 ある物質が分子のようなまとまりで表せない場合や
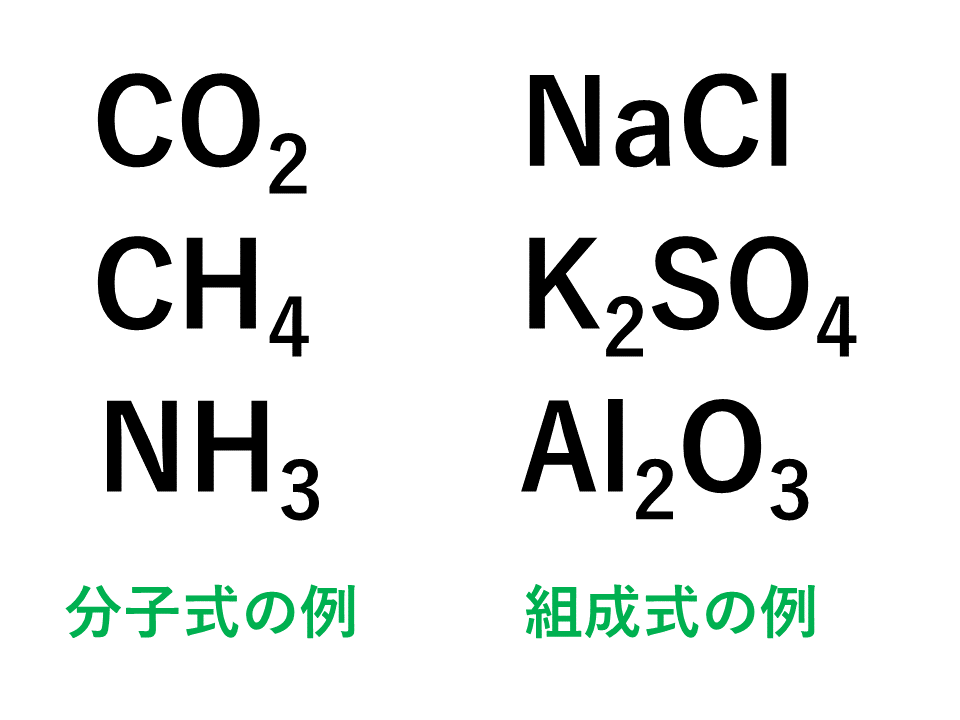
組成 式 一覧。 水素カリウム• ) 組成式〜構造式まで化学式まとめ 化学式には、大きく分けて ・分子式 ・組成式(実験式) ・構造式 ・示性式 があり、特に注意するところは『共有結合結晶が組成式で表される』、『構造式には何通りもの描き方が そのため、 陽イオンと陰イオンの数を最も簡単な整数比 にした 組成式 というものを使って表します。 例えば、 塩化ナトリウムであれば、Na :Cl - = 1:1の割合で結合しているため、NaClと書きます。 硫酸カリウムであれば、K :SO 42- = 2:1 の割合で結合しているため、K 2 SO 4 と書きます。 酸化アルミニウムであれば、Al 3 :O 2- = 2:3 の割合で結合しているため、Al高校講座home >> 化学基礎 >> 第12回 分子と共有結合;




塩化ナトリウム Nacl の化学式 分子式 構造式 電子式 イオン式 分子量は 塩化ナトリウムと硝酸銀の反応式



組成式とは
イオン結合・イオン結晶・へき開・組成式 陽イオンと陰イオンが、静電気的な力で引き合う結合。 陽イオンと陰イオンが、規則正しく並んでいる結晶。 熱して液体にしたり、水溶液にすると、イオンが 溶けて自由に動けるようになるため電気を通す1 水素イオン H + 1 リチウムイオン Li + 1 ナトリウムイオン Na + 1 カリウムイオン K + 2 マグネシウムイオン Mg 2+ 2 カルシウムイオン Ca 2+ 2 バリウムイオン Ba 2+ 2 亜鉛イオン Zn 2+ 3 アルミニウムイオン Al 3+ 2 鉛(Ⅱ)イオン Pb 2+ 3 クロム(Ⅲ)イ組成式の基本問題1 問1 次のイオン結晶について,物質名は組成式を,組成式は物質名をそれぞれ書きなさい。 塩化ナトリウム MgO 水酸化カルシウム CaCl 2 水酸化ナトリウム CaO 硝酸カリウム



2



緊急です 明日もしくは明後日までに理科の 組成式 のテストが Yahoo 知恵袋
化学:イオン結合(組成式) 対象 高1 再生時間 1143(3本合計) ※ 画面左上部の「再生リスト」を押すと一覧が表示されます。 説明文・要約 ・イオン結合でできている物質は「組成式」によって表現(結晶ができてしまい、分子と違って 左辺の係数はこれ以上小さくすることはできないので、この数が組成の最小単位となり、組成式はMgCl₂になります。 考え方はこんな感じなんですが、簡単に考えれば 価数の比を逆にしたものは組成するイオンの個数比 になるんですよね。基本的に,イオン結晶は「金属元素」と「非金属元素」の両方で構成されています。ただし,塩化アンモニウムnh 4 clなどのアンモニウムイオンnh 4 + を含む物質は非金属元素だけで構成されていますが,イオン結晶として存在しています。




化学基礎テ対 物質の構成 化学結合 高校生 化学のノート Clear 化学結合 学習ノート 化学




炭酸カルシウム Caco3 の化学式 組成式 構造式 電子式 分子量は
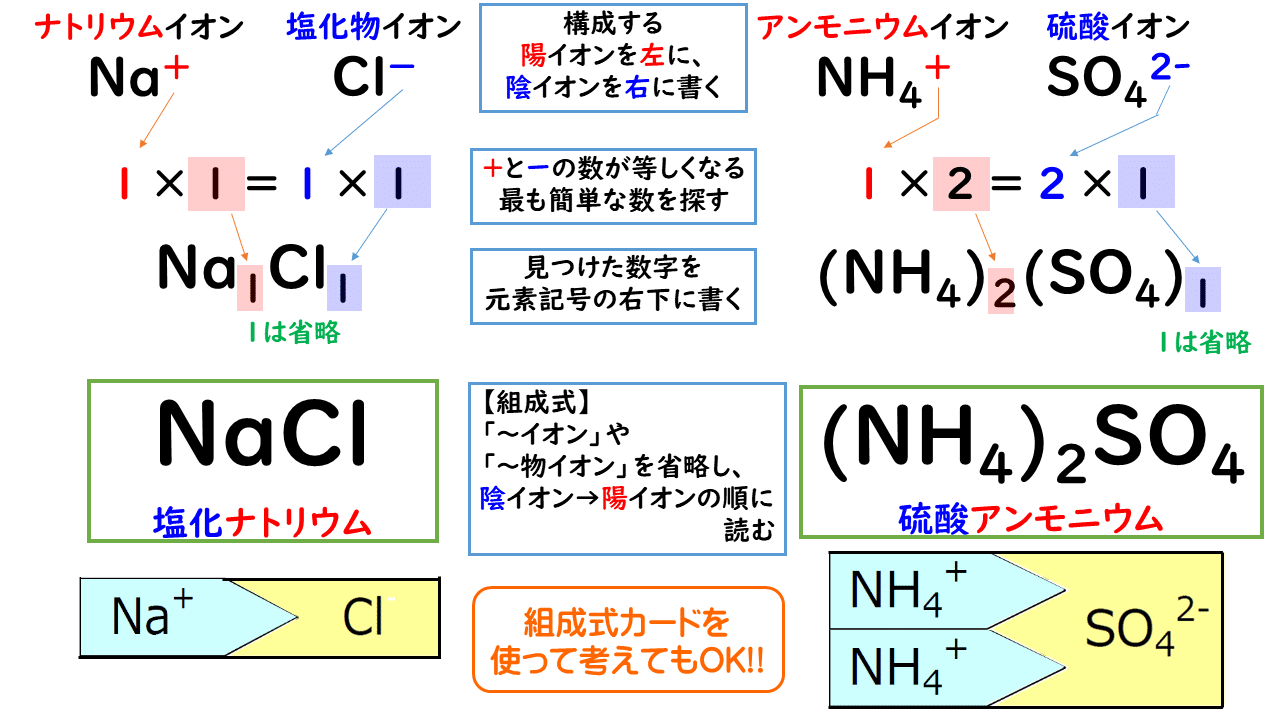
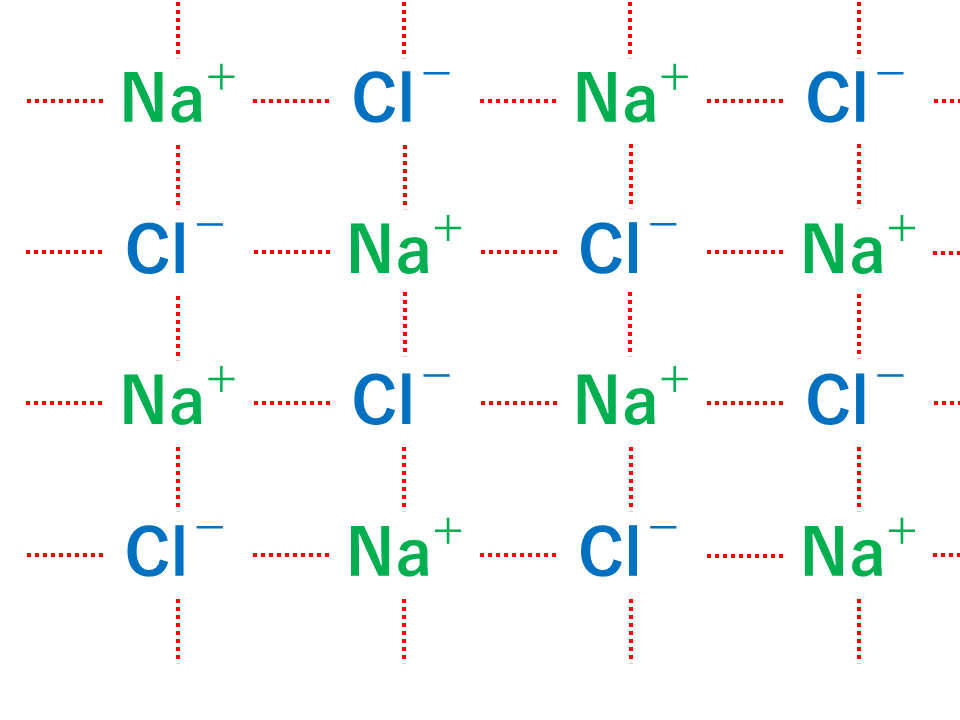
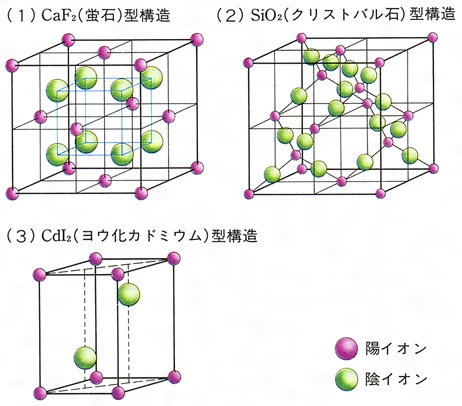
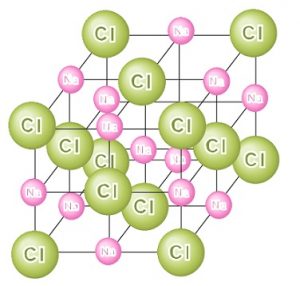
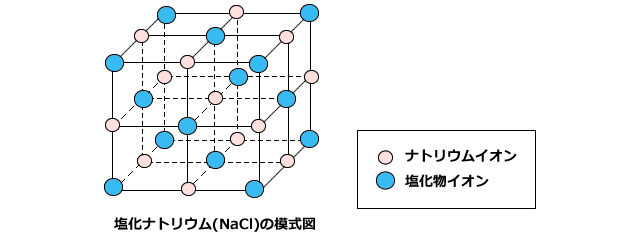
イオン結晶 粒子が規則正しく並んでできた固体を結晶といい、特にイオン結合によってできた結晶を イオン結晶 という。イオン結晶には以下のような特徴がある。 水に溶けてイオンになる イオン結晶の物質は水に溶けてイオンになる。博士 それは、ナトリウムイオンNa が陽イオンで塩化物イオンCl − が陰イオンだからさ。 +と−は引かれ合うんだよ。 ケミ太 プラスとマイナスが引かれあって結合するなんて、静電気みたいですね。 博士 まさにその通りで、この引力は静電気力(クーロン力)と呼ばれているよ。 博士 イオン結合は「陽イオンと陰イオンが静電気的な引力によって結合する なので、イオン結晶を表す化学式は、陽イオンと陰イオンがどのくらいの割合で結びついているか、その割合を最も簡単な整数比で表した式、組成式で表します。 組成式を書くときには、 ① 構成する陽イオンを左に、陰イオンを右に、電荷を取った(右上の数字と符号を除いた状態で)書きま




なんですか これ Clearnote




なぜ分子結晶の時は分子式で 金属結晶 イオン結晶 共有結合結晶の時は組成式なんですか よくわかりません Peing 質問箱
陽イオンが1価、陰イオンが1価のときは1:1です。 ナトリウムは1価の陽イオン( )で+1、 塩素は1価の陰イオン( )で-1、 になります。 だから1:1のとき電荷は全体で、1×(+1)+1×(-1)=0(中性) 塩化ナトリウムの組成式は、 陽イオン2価、陰イオンが1価のときは1:2です。 カルシウムは2価の陽イオン( )で+2、 塩素は1価の陰イオン( )で-1、イオン式とは イオン式の一覧と読み方を一挙公開 化学受験テクニック塾 陽イオン 陰イオン 組成式 一覧 なんなら、分子にだって組成式はあります。 (例えば、グルコース分子式C 6 H 12 O 6 の組成式はCH 2 O) なので、イオン結晶の比を表すという記述は間違い! イオン結晶の組成式の書き方 ステップ1:イオンを陽イオン→陰イオンの順に並べる Na + Cl – ステップ2:陽・陰イオンの数の比を求める(電荷が0になるようにする) NaとClは1と1なので11で電荷が0になりますね



2




化学基礎 イオン結合の組成式 その4 名称 Youtube
イオンクロマトグラフィー担体 sca, sckシリーズ カタログ番号 製品名 包装量(g) 基体組成 官能基 対イオン 粒径(μm) イオン交換容量(meq/g) 主な用途;イオン結合とイオンからなる物質 イオン結合とイオンからなる物質 この表の答えが無いので間違いがないか教えて欲しいです Clear 12イオン結合の組成式その2作り方 Nagiraacademy 組成 式 一覧 ガラスの種類と組成 ガラスの基礎知識 国内大手加工ガラス 化学式は組成式で表します。 イオン結晶の見分け方 金属元素と非金属元素 が含まれた物質はイオン結晶です。 例えば、NaCl,BaSO 4 など。 例外として、 アンモニウムイオン NH 4 を含む場合もイオン結晶です。 例えば、NH 4 Clなど。 融点・沸点 クーロン力(静電気力)がかなり強いので,融点・沸点はかなり高いです。 機械的性質 クーロン力(静電気力)がかなり強いので硬い




酸化カルシウム Cao の化学式 組成式 構造式 電子式 分子量は 酸化カルシウムの水との反応式は



5分でわかる イオン結合とは 共有結合との違いと組成式 分子式を図で徹底解説 サイエンスストック 高校化学をアニメーションで理解する
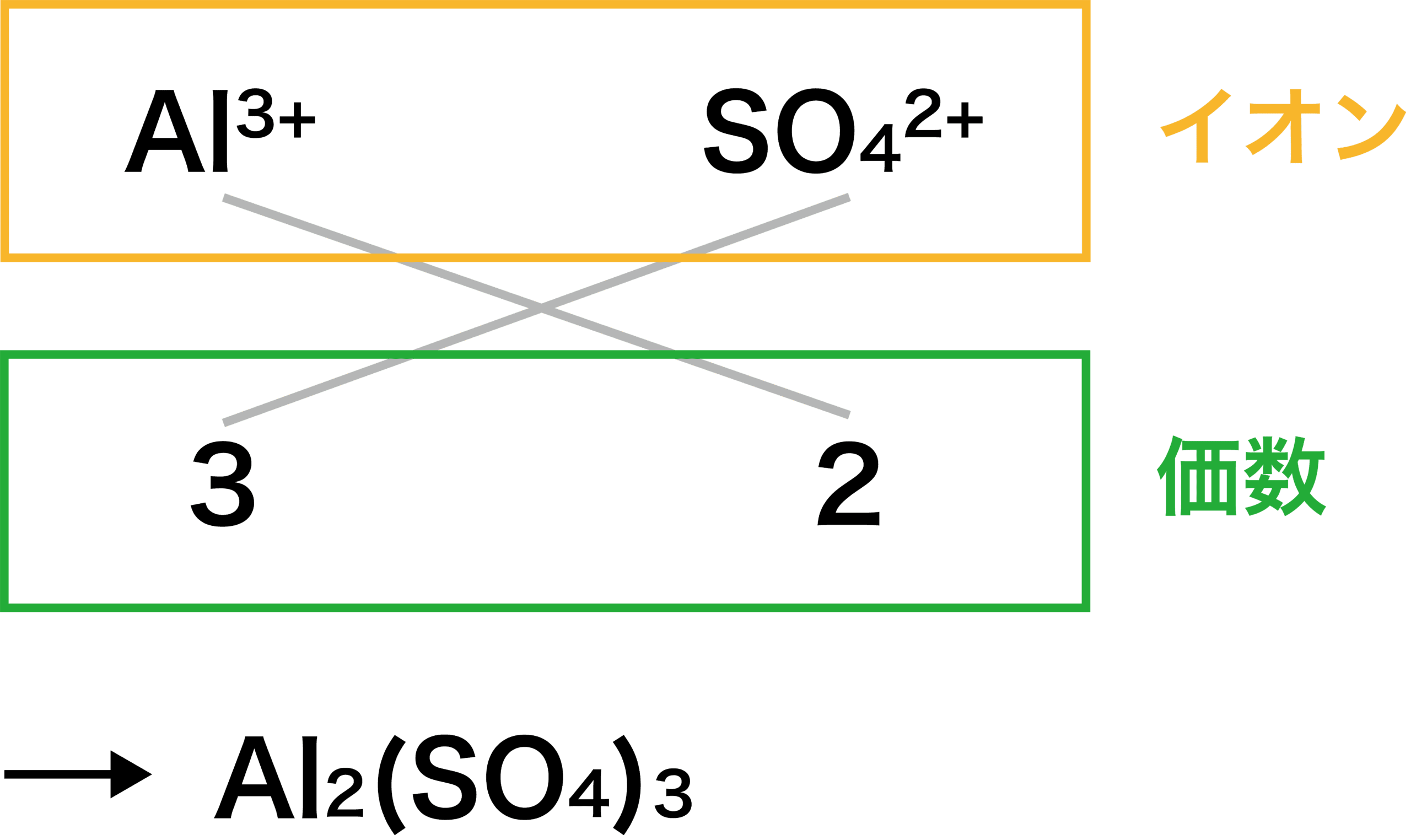
イオン伝導と結晶構造 第1図 固体イオニクスのイオン導電率(σ)の 温度依存の例(Reau and portier, 1978)。 かっこ内が拡散イオン。 結晶構造の研究は,物 性や導電機構を解明する上に,基 本的に重要なことで,X線,中 性 子回折により数多く研究されている。そしてイオン結合でできている結晶のことを イオン結晶 と言います。 イオン結合でできたものは 電気的に中性 です。 また イオンからなる物質は融点や沸点が高いものが多い です。 組成式の作り方 陽イオンの価数×陽イオンの数=陰イオンの価数×陰イオンの数 「Al3」と「SO4 2 」をくっつけてみましょう。 上記の公式を使うと 3×陽イオンの数=2×陰イオンの数 ですので 陽イオンの数=2、化学基礎 eテレ 毎週 水曜日 午後2:00~2: ※この番組は、21年度の新作です。




化学 共有結合の結晶 オンライン無料塾 ターンナップ




化学 板書 化学基礎 イオン結合とイオン結晶 T Co Qq1b2z6psh Twitter
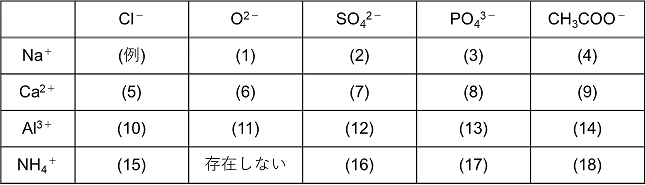
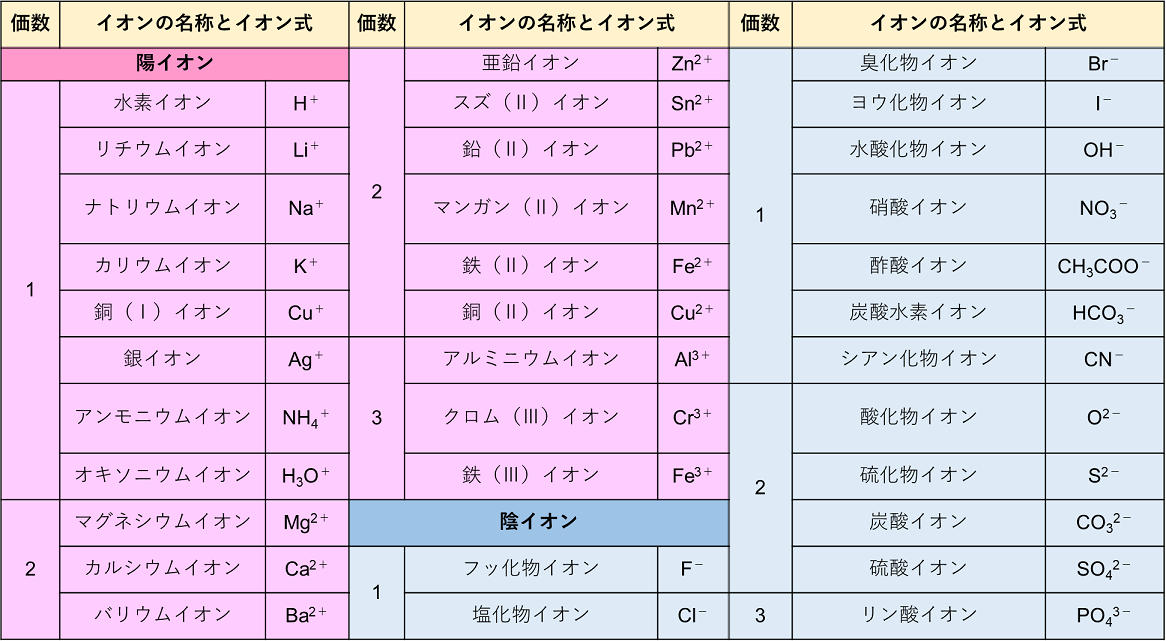
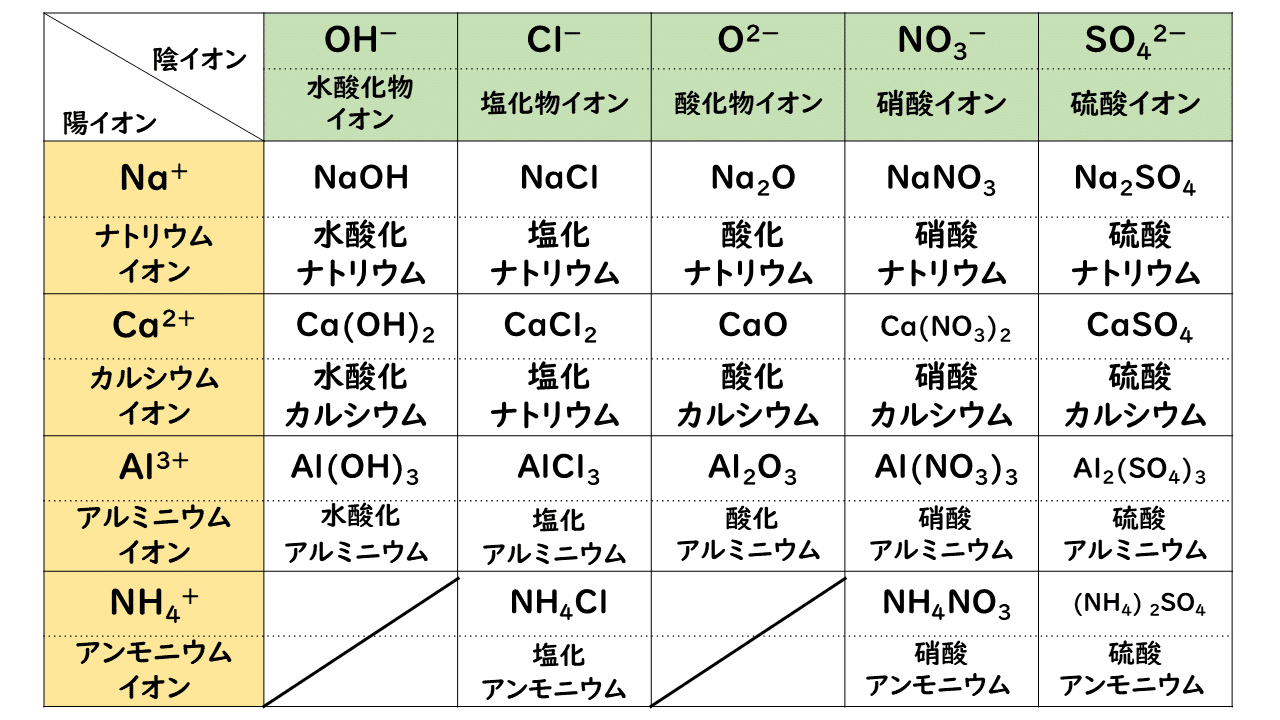
: 酢酸イオン ch 3 coo - の場合は,組成式は「陰イオンとその数,陽イオンとその数」の順で並べる。 例) Na + と CH 3 COO - 〔 CH 3 COONa 〕 ( NaCH 3 COO ではない) イオン式の例 水素イオンのイオン式 → H⁺ 亜鉛イオンのイオン式 → Zn²⁺ 銅イオンのイオン式 → Cu²⁺ 塩素イオンのイオン式 → Cl⁻ 水酸化物イオンのイオン式 → OH⁻ 硫酸イオンのイオン式 → SO₄²⁻ という感じだね。 なるほど。 「 化学式に電気の+や-がついたのがイオン式 」なんだね そういうこと! ではいよいよ、 イオン式の一覧をのせる よ! がんばって覚えてね! 覚えたら一覧 覚えたほうがよいもの ・陽イオン Na ナトリウムイオン K カリウムイオン (NH4) アンモニウムイオン Mg2 マグネシウムイオン Ca2 カルシウムイオン Al3 アルミニウムイオン ・陰イオン Cl 塩化物イオン NO3 硝酸イオン OH 水酸化物イオン (SO4)2 硫酸イオン (CO3)2 炭酸イオン (PO4)3 リン酸イオン 次に組み合わせ方を覚えます。



次のイオンが結合してできている イオン結晶の組成式と名称を答え Yahoo 知恵袋



第8章 イオン結晶



組成式の作り方について プラス マイナスのイオンの比で右上の数字が比 Yahoo 知恵袋




組成式とは 入試で必要な知識と勘違いするポイントをまとめてみた 化学受験テクニック塾



受験基礎化学 15 化学結合のまとめ みかみの参考書ブログ




液晶材料の研究開発 プロセス管理におけるソリューション Waters




金属結合とは 例 特徴 金属結晶 立方格子 理系ラボ




1 2 1 イオン結晶と組成式 化学基礎 Youtube



分子結晶



第8章 イオン結晶




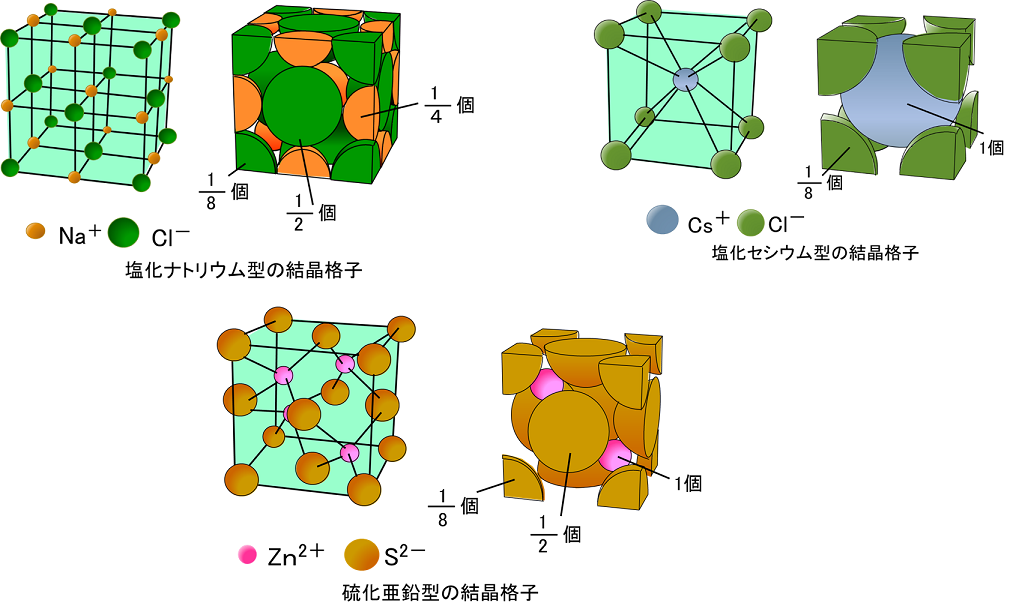
なぜaの単位格子の角1つは4分の1なのにbの単位格子の角1つは8分の1なので Clearnote




これを見ても 組成式の作り方が分かりません Clearnote




化学基礎 イオン結合の組成式 その2 作り方 Youtube




化学基礎



3 1 イオン結合とイオン結晶 おのれー Note



1 3 イオン結晶の構造 おのれー Note



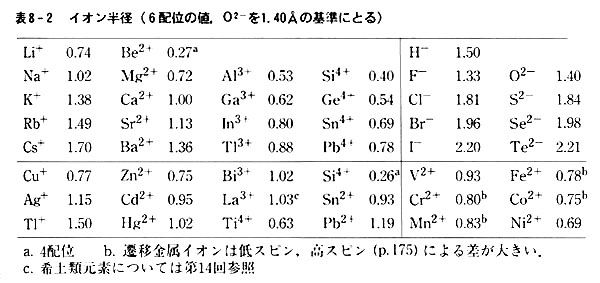
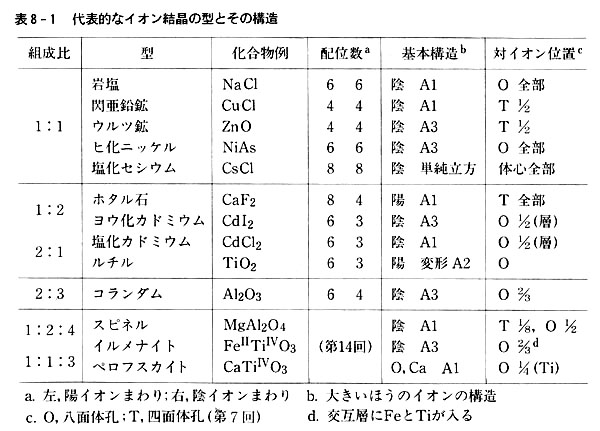
Ppt 3 2 イオン結晶の構造 イオン間に働くクーロン静電力は方向性をもたないので イオン結晶の構造は陰イオン 半径 R 陽イオン 半径 R の数の比 半径比 分極率によって支配される Powerpoint Presentation Id



分子式 組成式 化学式 見分け方と違いは 演習問題




化学 1 Flashcards Quizlet



化学基礎高校一年生です 組成式の書き方がよくわかりません プ Yahoo 知恵袋



5分でわかる イオン結合とは 共有結合との違いと組成式 分子式を図で徹底解説 サイエンスストック 高校化学をアニメーションで理解する



イオン結合とイオンからなる物質




高校化学 結合 イオン結合 組成式の書き方 オンライン無料塾 ターンナップ Youtube
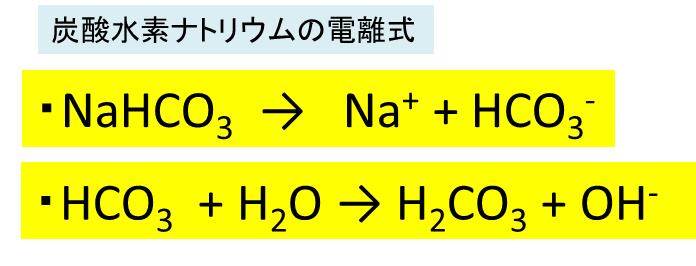



炭酸水素ナトリウム Nahco3 の化学式 分子式 構造式 電子式 イオン式 分子量は 炭酸ナトリウムの工業的製法



イオン結合の組み合わせ理科の講義ノート Lecture Notebook



組成式




イオン結合とは 例 結晶 共有結合との違い 半径 理系ラボ




Wo17 号 硫化物固体電解質 Astamuse



イオン結合と結晶




化学式とは コトバンク




組成式とは 入試で必要な知識と勘違いするポイントをまとめてみた 化学受験テクニック塾



2



試験を生かす 期末試験から 高校化学の教材 分子と結晶模型の ベンゼン屋 楽天ブログ



結晶構造とは コトバンク



電子式



イオン結合でできるイオン結晶を表す組成式って何



化学講座 第10回 イオン結合とイオン性物質 金属結合と金属結晶 私立 国公立大学医学部に入ろう ドットコム



イオン結合の組み合わせ理科の講義ノート Lecture Notebook




イオン結合とは 例 結晶 共有結合との違い 半径 理系ラボ




イオン結晶 Wikiwand




イオン結晶とは イオン結晶のポイントを分かりやすく解説 高校生向け受験応援メディア 受験のミカタ




イオン結合でできるイオン結晶を表す組成式って何
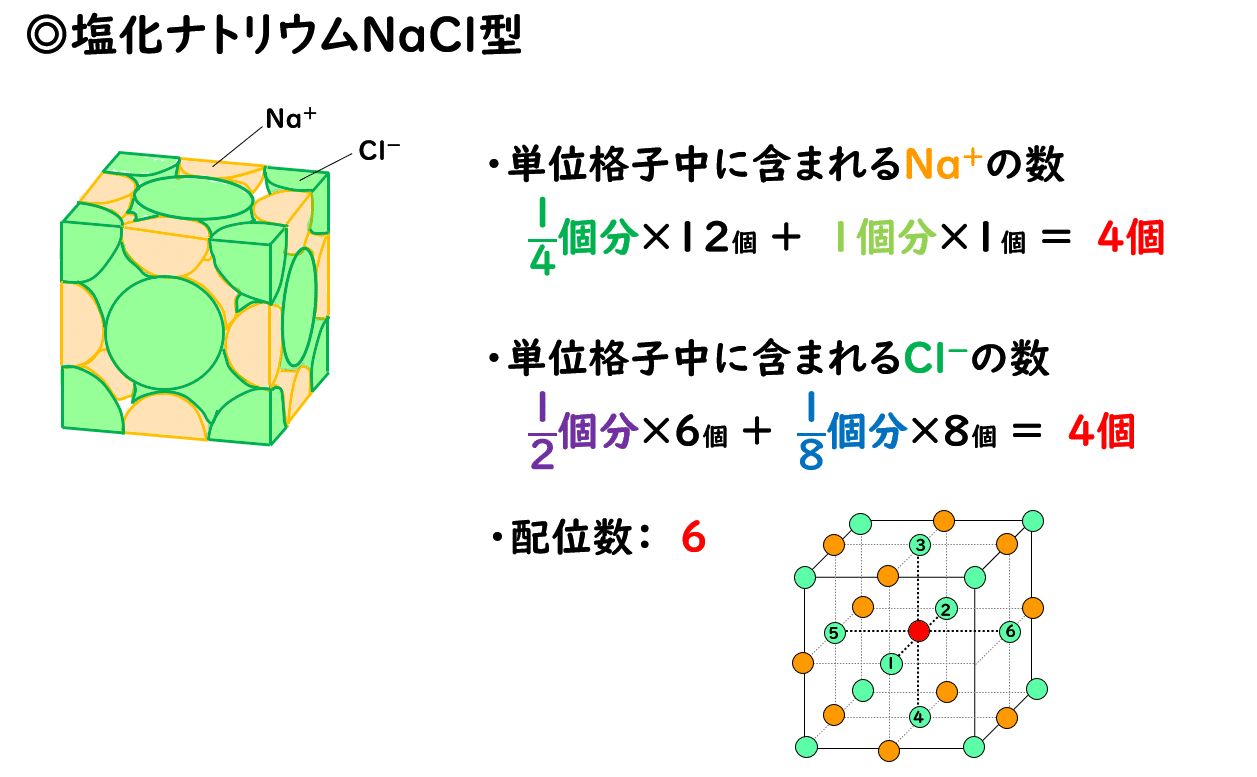



1 3 イオン結晶の構造 おのれー Note




化学基礎テ対 物質の構成 化学結合 高校生 化学のノート Clear 化学結合 化学 高校 勉強



高一化学 炭酸イオンとマグネシウムイオンの組成式はこれで合ってます Yahoo 知恵袋




あっていますか Clearnote




組成式とは 分子式との違いも解説 一覧表つき 高校生向け受験応援メディア 受験のミカタ



解説お願いします 下図は 原子aの陽イオン と原子bの陰イオン Yahoo 知恵袋
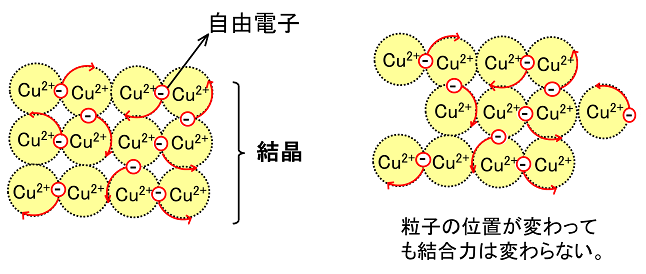



金属結合と金属




02 3348号 層状岩塩型リチウム鉄酸化物およびその製造方法 Astamuse




イオン結合 例 共有結合との違い 特徴 強さなど 化学のグルメ




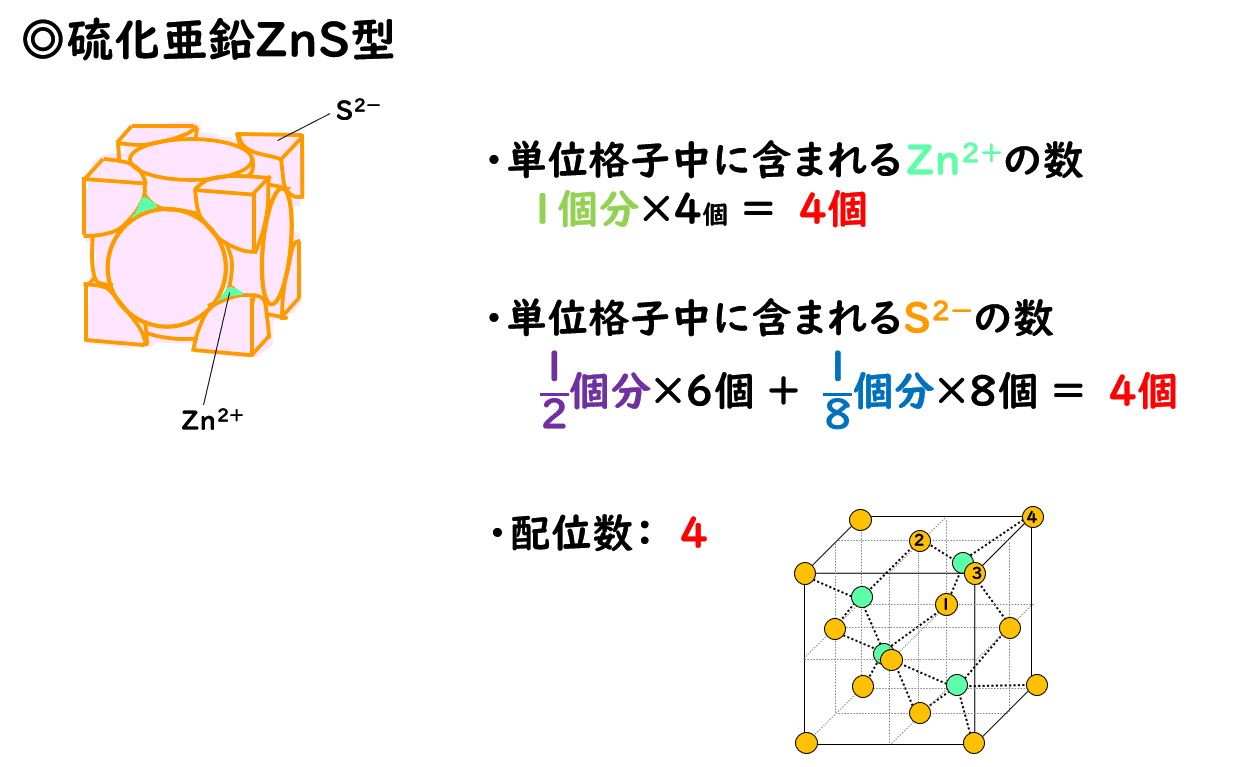
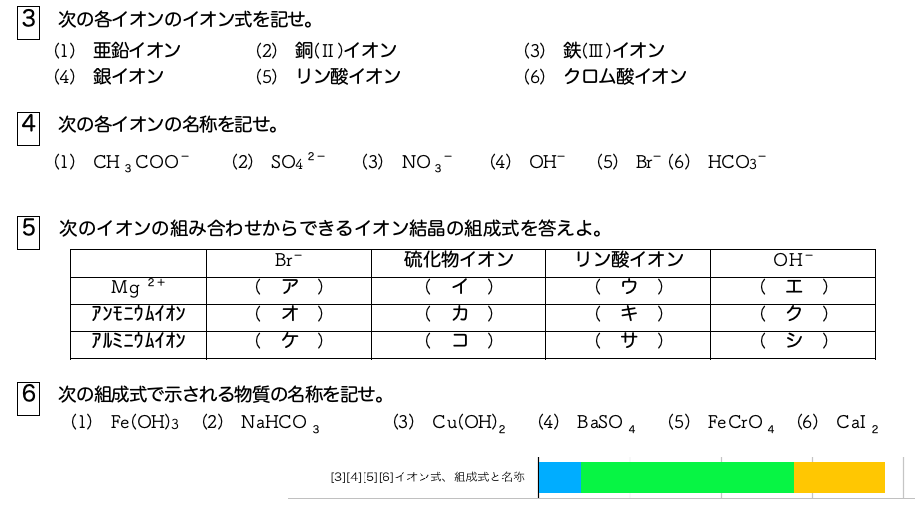
高校理論化学 その他のイオン結晶 Caf Sub 2 Sub 型 Zns型構造 受験の月



2




全然わかりません わかる方いたら教えて下さると嬉しいです Clearnote



3 1 イオン結合とイオン結晶 おのれー Note




イオン結晶の物質はすぐに書ける 化学がちょっとだけ好きな社労士



2



2




組成式 Twitter Search Twitter
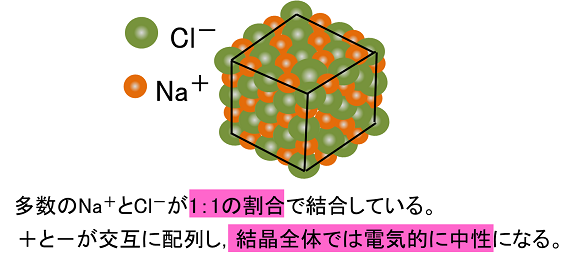



イオン結合とイオンからなる物質




組成式とは 入試で必要な知識と勘違いするポイントをまとめてみた 化学受験テクニック塾
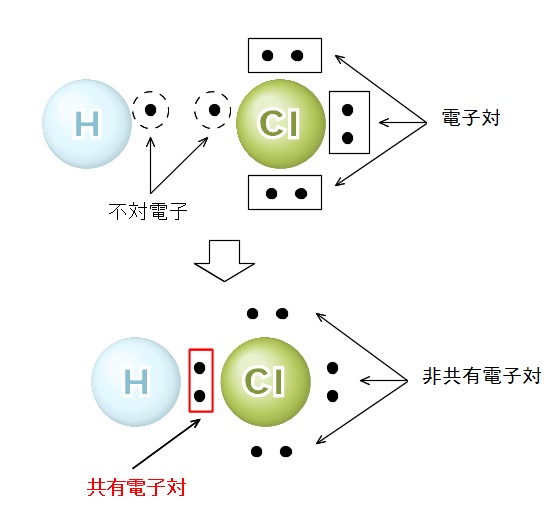



物質の構造と構成 の記事一覧 2 4ページ目




組成式と分子式の違いは なぜsio2が組成式なのか 化学受験テクニック塾




あってますか Clearnote




21 号 非晶質リチウムイオン伝導酸化物粉末およびその製造方法 並びに nasicon型結晶構造を有するリチウムイオン伝導酸化物粉末の製造方法 Astamuse




14 号 非水電解質リチウムイオン二次電池用正極材料およびその正極材料を用いた非水電解質リチウムイオン二次電池 Astamuse
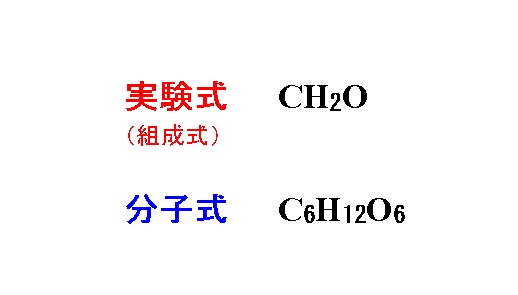



有機化合物の実験式 組成式 を求める計算と分子式の決定




イオン結晶 共有結合の結晶 分子結晶まとめ 理系ラボ
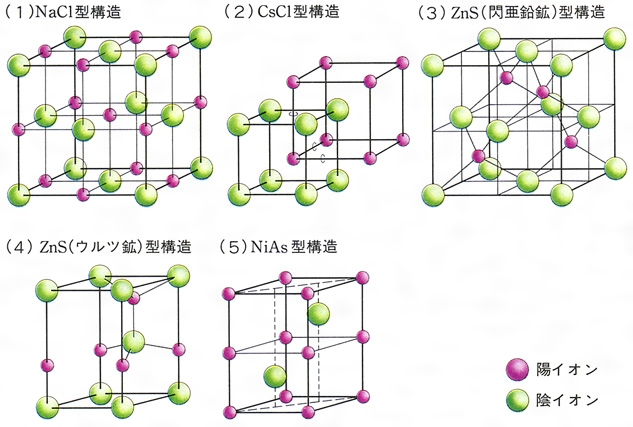



結晶構造とは コトバンク




について質問です Clearnote
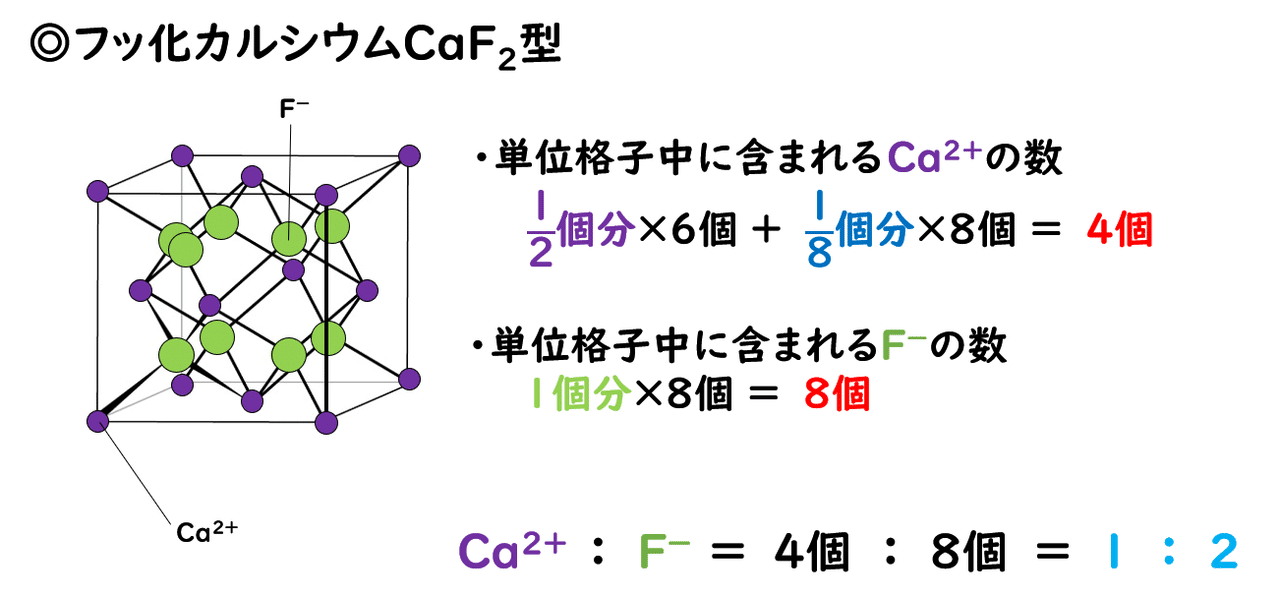



1 3 イオン結晶の構造 おのれー Note
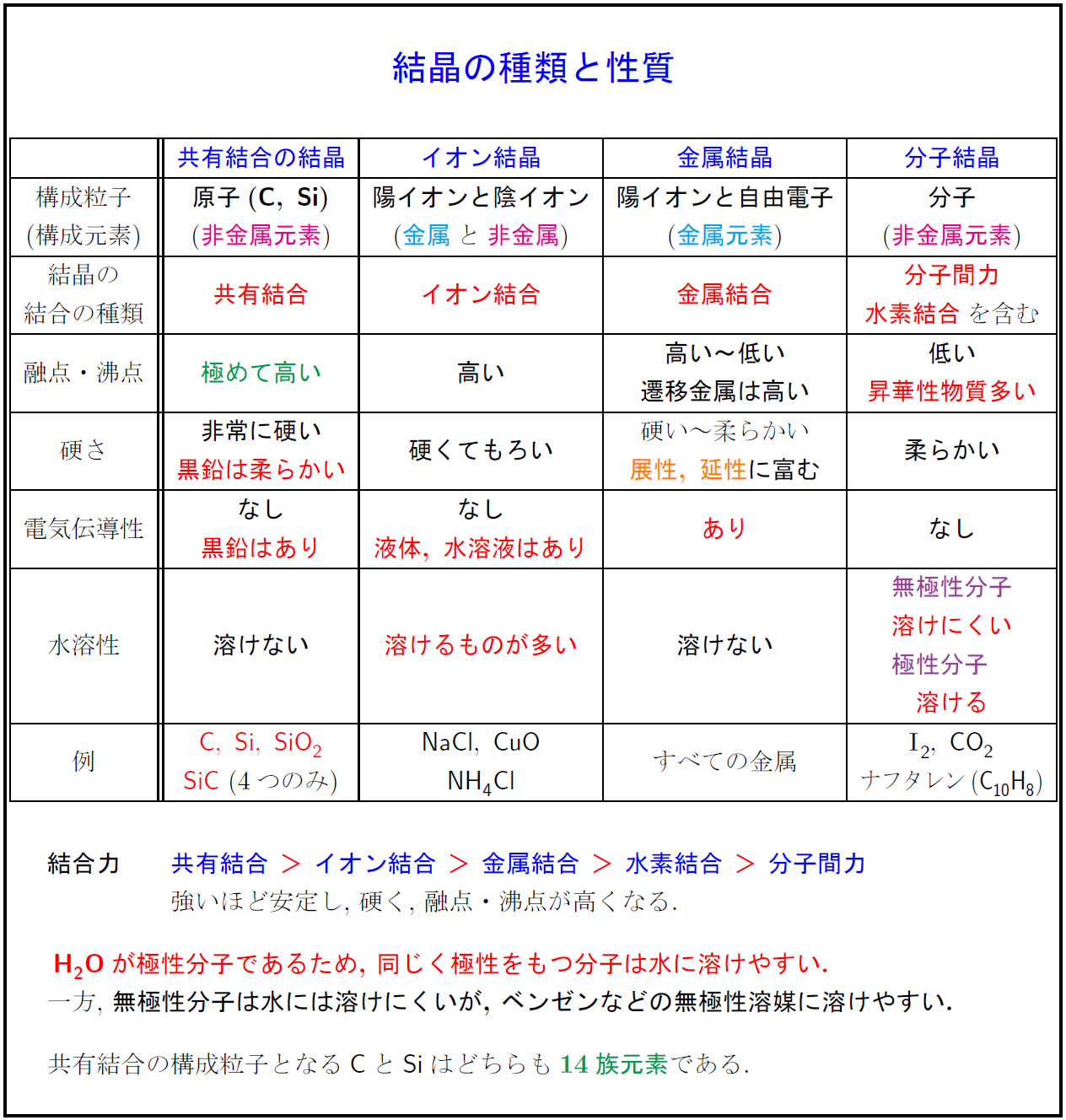



高校理論化学 結晶4種類 共有結合の結晶 イオン結晶 金属結晶 分子結晶 と性質まとめ 受験の月




組成式 Twitter Search Twitter
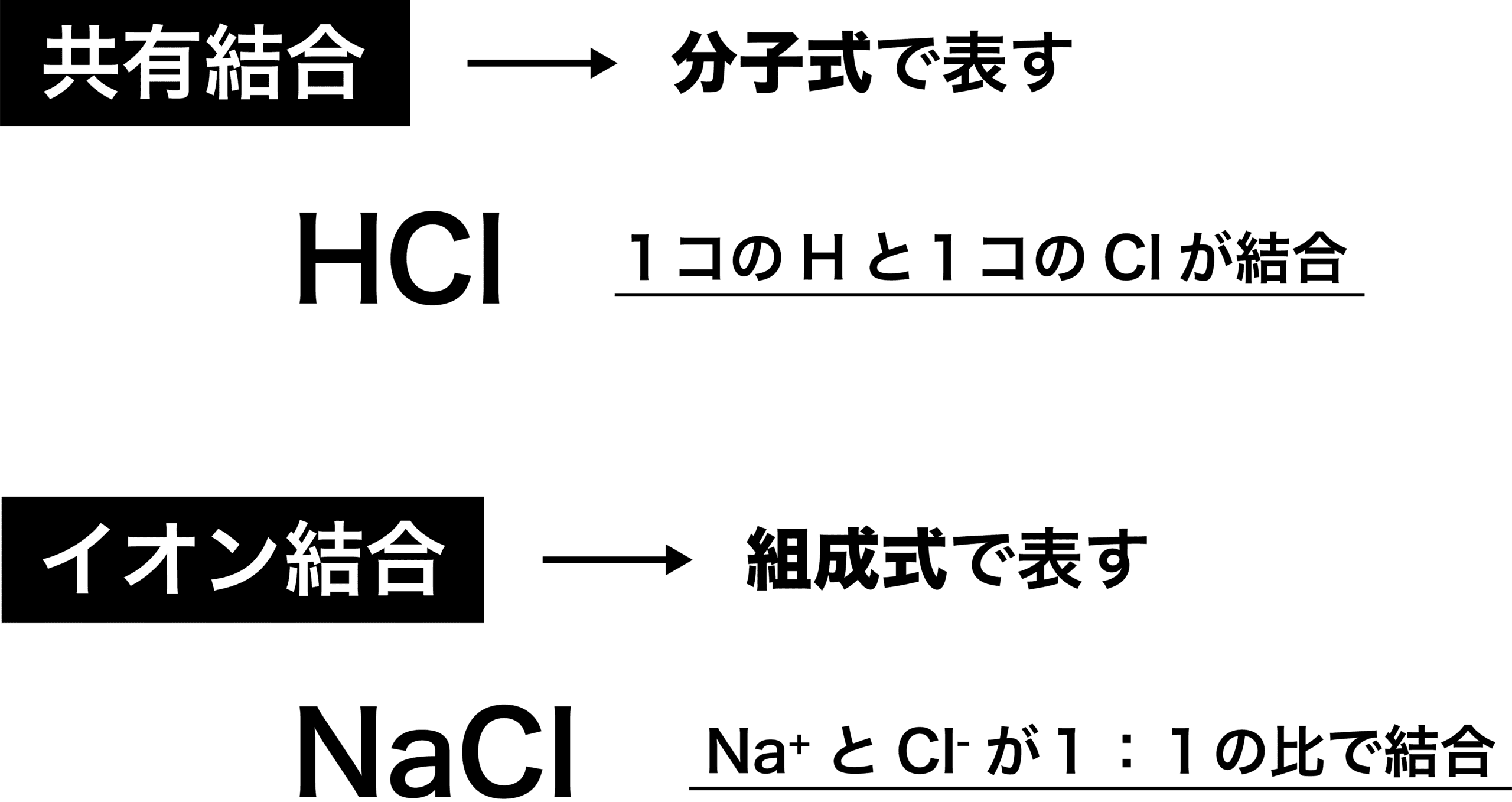



イオン結合 例 共有結合との違い 特徴 強さなど 化学のグルメ




化学基礎 イオン結晶の組成式 Youtube



緊急です 明日もしくは明後日までに理科の 組成式 のテストが Yahoo 知恵袋
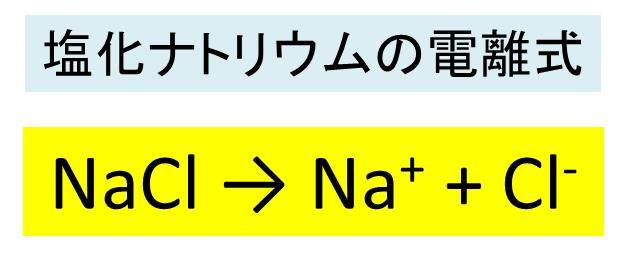



塩化ナトリウム Nacl の化学式 分子式 構造式 電子式 イオン式 分子量は 塩化ナトリウムと硝酸銀の反応式




化学基礎テ対 物質の構成 化学結合 高校生 化学のノート Clear 化学結合 中学 勉強 化学




危険物資格取得のための高校化学no 10 組成式 F M サイエンスブログ




イオン結合とイオンからなる物質



イオン結晶 化学基礎 高校化学net参考書




イオン結合とイオン結晶
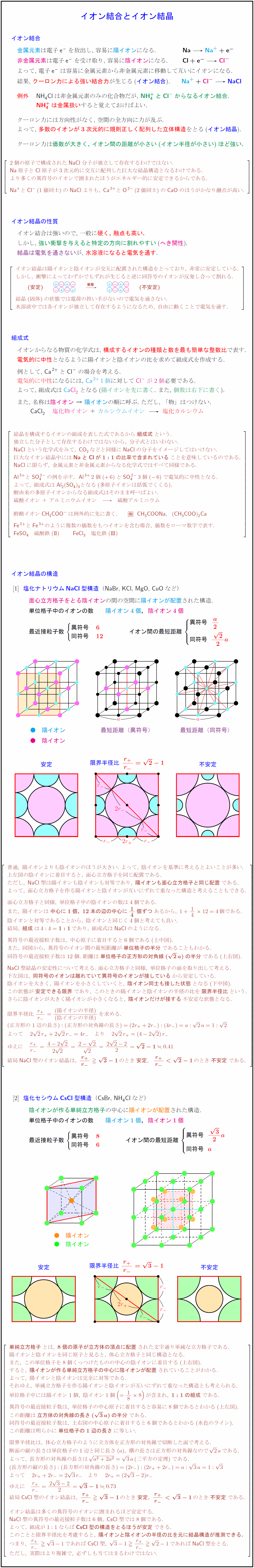



高校理論化学 イオン結合とイオン結晶 Nacl型 Cscl型構造 イオン限界半径比 受験の月




15 号 ナトリウムイオン電池用正極活物質およびこれを用いたナトリウムイオン電池 Astamuse
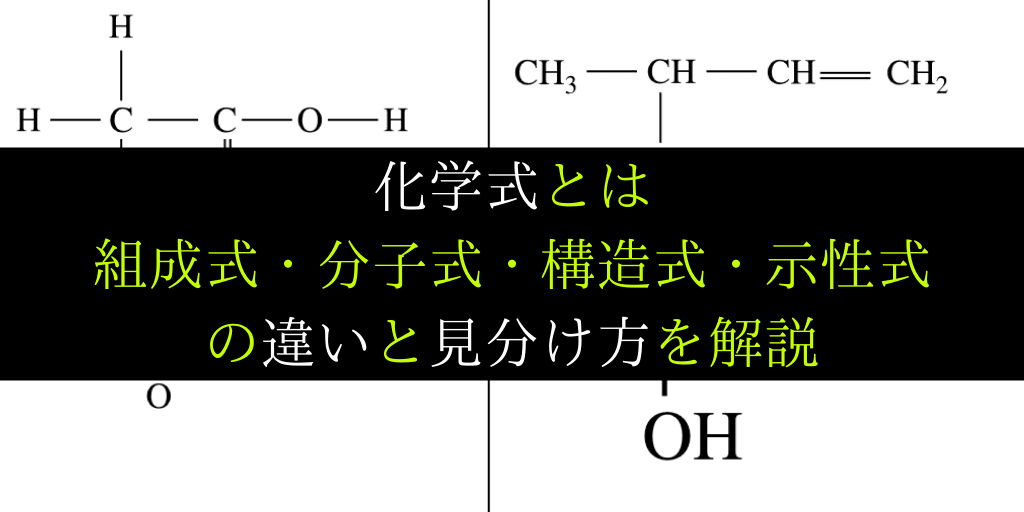



化学式 組成式 分子式 示性式 構造式の違いと見分け方を具体例で解説




高校化学基礎 組成式の書き方 映像授業のtry It トライイット
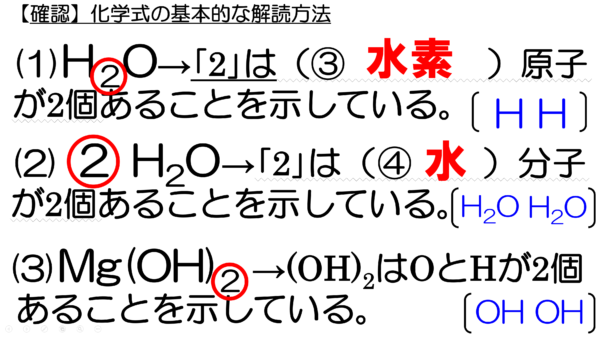



危険物資格取得のための高校化学no 10 組成式 F M サイエンスブログ




18 号 硫化物固体電解質 Astamuse
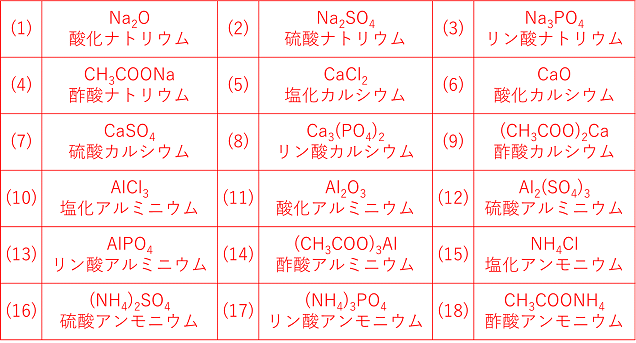



イオン結合とイオンからなる物質



イオン結合とイオンからなる物質



0 件のコメント:
コメントを投稿